突破瓶颈!Science:我国科学家成功建立乙肝病毒感染模型
内容来源:生物探索
说起乙肝,很多人都不陌生。据统计,中国的肝脏病患者约有4亿人,占全球肝脏病人的40%。这其中约有1.2亿人携带乙肝病毒。目前也还未找到有效的治愈方法。

北京大学邓宏魁教授
近日,北京大学邓宏魁研究组、解放军总医院卢实春研究组以及复旦大学袁正宏研究组联合发表在《Science》杂志上的一篇论文,为肝病治疗带来了希望的曙光。研究显示,科学家们首次证明了一种化学小分子可以调控细胞信号通路,帮助实现功能性肝细胞在体外的长期维持。此外该研究还证明了肝细胞在体外支持乙型肝炎病毒(HBV)及丙型肝炎病毒(HCV)的长期持续感染。这项研究为大量制备功能成熟细胞及其应用提供了可能。

DOI: 10.1126/science.aau7307
肝脏疾病研究的痛点
肝脏疾病目前还未找到有效的治愈方法,究其主要原因是肝脏疾病的研究一直缺乏良好的体外模型。
原本,人肝原代细胞(PHHs)是较为理想的研究模型。但是功能性肝细胞很是脆弱,一旦离开体内微环境便会迅速去分化并且失去正常功能。
此外,由于缺乏合适的培养条件和微环境,在体外通过干细胞诱导分化成的功能细胞很难真正成熟并长期维持其功能。因此,如何诱导获得功能成熟的细胞并在体外保持其功能性是再生医学的关键瓶颈。
在过去几十年中,各国科学家们都在努力探索,尝试着改变培养材料、培养方法等。但可惜的是,都没有能建立起一个简单高效且相对稳定的功能细胞体外培养体系。
小分子具有大作用
邓宏魁教授跟他的团队发现,有5种化学小分子组合(5 compounds,5C)可以在体外帮助实现肝细胞功能的长期维持。5C组合抑制了肝细胞的去分化,使得体外肝细胞整体基因表达与体内肝细胞有着高度的相似性,并且还能长期维持白蛋白分泌、尿素合成、药物代谢等正常的肝细胞功能。

5C处理使人肝原代细胞得在体外长期培养下保持正常形态和增殖特性
相比于传统遗传学方法,化学小分子能够实现对多个信号通路靶点的精细调控。化学小分子诱导重编程从问世之初一直受到大家关注,相比于传统转基因方法介导的重编程,化学小分子不但可以避免内源基因修改带来的风险,它同时兼具了细胞膜穿透性、可逆性、可控性和易于制造等诸多优点。
该研究表明,化学小分子在精细调控细胞命运和功能上的优越性,这一方法也为其他类型细胞体外功能的长期维持提供了新的途径。
乙肝病毒感染模型建立
在发现5C组合具有抑制细胞分化的作用后,邓宏魁研究组联合解放军总医院卢实春研究组以及复旦大学袁正宏研究组成功建立起首个乙肝病毒感染模型。持续高水平表达乙肝表面抗原、e抗原、合成乙肝病毒DNA等感染指标,尤其是能够长期稳定产生乙肝病毒复制必需的cccDNA。
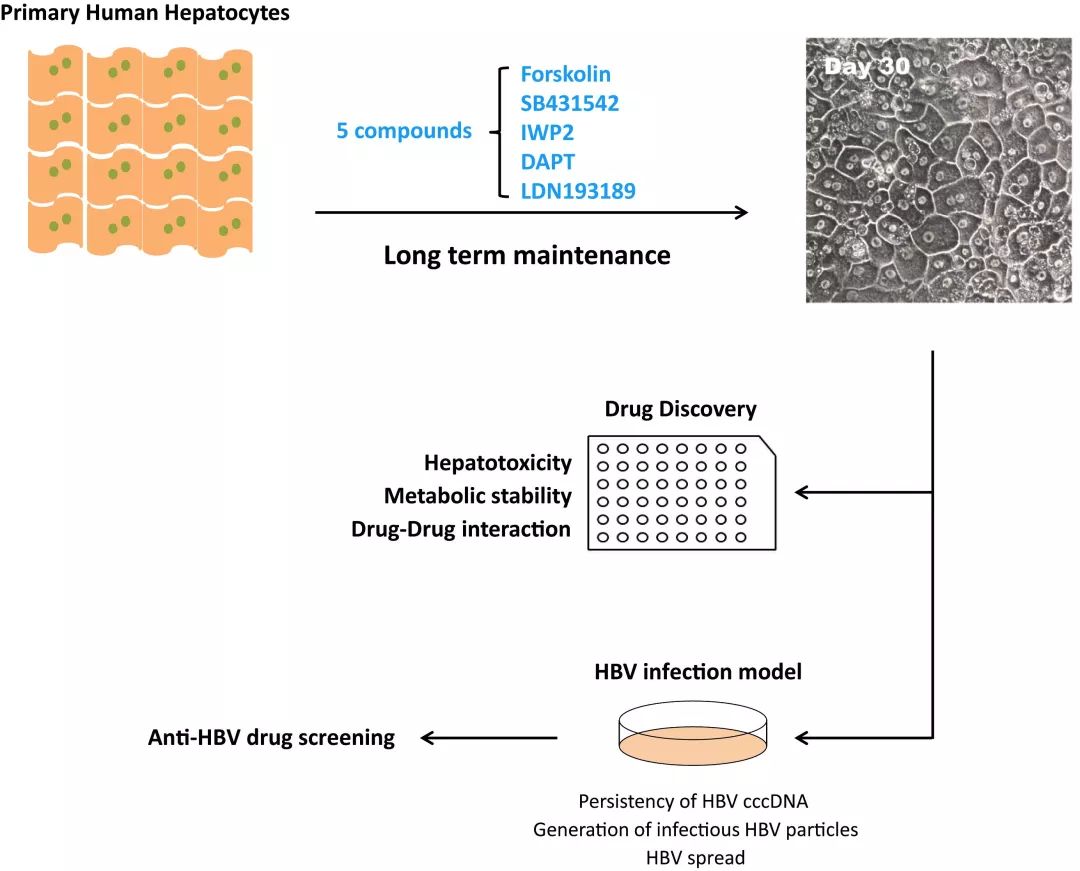
人原代肝细胞在5个化学小分子的协同作用下,能够在体外长期维持功能。
这一模型的建立,对于乙肝病毒的深入研究与药物研发具有重要意义。因为乙肝病毒侵入肝细胞后,,形成了一种很难被清除的病毒复制模板cccDNA,,目前还没有针对这个病毒复制关键靶点的药物。
相形之下,丙型肝炎病毒的发现虽然晚于乙肝病毒,但基于有效的体外病毒感染模型,已成功筛选并获得治愈丙肝的药物。5C培养条件下的肝细胞支持乙肝病毒的高效感染,并能够长期产生cccDNA,可作为理想的药物筛选模型,为治愈乙型肝炎带来希望。
中国工程院院士闻玉梅指出,这种仅用5种化学小分子处理来体外长期培养人肝原代细胞的方法易于实现,极适用于药物的高通量筛选,为肝脏疾病的治疗提供了更为简便的研究工具,具有重大的现实意义。
参考资料:
[1] Long-term functional maintenance of primary human hepatocytes in vitro
[2] 邓宏魁研究组与合作者在Science发表论文报道功能成熟细胞在体外长期维持的新方法
[3] 我科学家成功建立乙肝病毒感染模型
内容来源:新京报,版权归原作者所有
如有侵权,请联系删除
卓诚惠生——追求品质卓越,致力健康事业
了解更多资讯,请识别下方二维码,关注卓诚惠生~
